오늘, 셀트리온 바이오시밀러 제품인 유플라이마(원제품명 : 휴미라)가 EC에서 승인이 났다는 기사가 떴습니다. 의도치 않게 또 셀트리온이군요. 오늘은 기사 뜨자마자 분석한 거라 아직 애널리스트 보고서가 새로 나온 게 없더라고요. 괜찮습니다. 제가 직접 분석하죠. 바쁘신 분들은 마지막 <정리>로 바로 넘기시면 됩니다!
1. 이슈


오리지널 제품은 휴미라이고 성분명은 adalimumab이라는군요. 현재 유럽시장의 90%는 고농도 제형이라고 합니다.
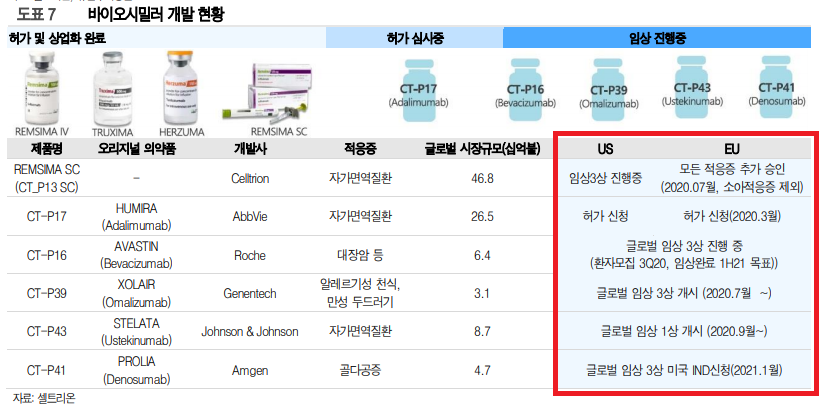
그나저나 CT-P17을 어디서 본 것 같아서 찾아봤더니 제가 썼던 셀트리온 공매도 이슈 때 주가 분석했던 포스팅에 있더라고요. 이제 EU 허가 신청 -> 승인 으로 바꿔야겠네요.
셀트리온 공매도 이슈 중간 리뷰, 주가 전망 (tistory.com)
셀트리온 공매도 이슈 중간 리뷰, 주가 전망
어제 포스팅에서 게임스탑에서 시작되어 우리나라 셀트리온에서 개인들과 공매도 세력들과의 전쟁을 보여드렸습니다. 골드만삭스와 JP모건이 째리는 모습이 인상적이어서 가슴이 웅장해지던
ddacapo.tistory.com
근데, 저는 블로그만도 못한, 키워드 퍼다 나르는 몇몇 인터넷 언론기사 믿지 않습니다. 팩트체크 해봐야죠.
2. 팩트 체크

올해 그러니까 2021년 2월 5일에 류마티스 관절염 환자를 대상으로 한 기존의 adalimumab EU 바이오 시밀러들과
CT-P17의 효능성(efficacy)과 안전성(safety)을 비교한 논문입니다. 이 논문에 따라 이것이 adalimumab 성분의 바이오시밀러로서의 자격을 갖추는지 확인해 볼 수 있겠습니다.

결론은 같은 효능성과 비교할만한 안정성을 보인다는군요. 전체적인 안전성은 이미 알려진 안전서 프로파일과 일치한다고 합니다.
실제로 CT-P17은 2020년 12월 11일에 EC의 산하기관인 CHMP 승인 권고를 이미 받았습니다. 승인 권고를 받으면 2~3달 안에 거의 승인된다고 하네요. 아는 사람들은 이미 작년 말 시장에 선반영 시켰을 것 같습니다.
팩트 체크 결과 신뢰할만한 정보였습니다.
3. 유플라이마 승인이 가지는 의미
1) 시장 규모
일단 Adalimumab이라고 하는 물질은 간단하게 말해서 면역억제제입니다. 흔히 부르는 약제 그룹명으로 DMARDs라고 하는데 disease-modifying anti-rheumatic drugs의 줄임말로 항류마티스 계열 약제라는 뜻입니다. 전통적인 DMARD제재는 약 효능을 나타내는 농도에서 부작용이 많았습니다. 이에, 특별한 면역 물질을 targeting하는 물질들을 개발하기 시작했고 이것을 biologic DMARDs(anti TNF-a)라고 합니다. 아달리무맙은 여기에 해당한다고 보면 됩니다.
그래서 이 약을 어디다 쓰는 약이냐 하면, 류마티스 관절염(rheumatoid arthritis), 강직성 척추염(ankylosing spondylitis), 크론병(Crohn's disease), 궤양성 대장염(ulcerative colitis), 건선(psoriasis) 등에 사용합니다. 주된 부작용은 상기도 감염, 맞은 부위 통증, 발진, 두통 등이라고 합니다.
이렇게 다양한 자가면역질환에 쓰이는 Adalimumab을 최초로 개발하여 출시된 제품명이 휴미라입니다.

유진투자증권 한병화 애널리스트의 보고서에 따르면 휴미라 바이오시밀러로서의 시장규모는 265억 달러라고 합니다.

실제로 2016년 글로벌 의약품 한해 매출액 순위에서 휴미라는 1위를 차지했고 160억 달러이며 YoY 증가율은 14%를 기록하고 있습니다. 시장 규모 자체는 상당합니다.
2) 타 경쟁사 대비 이점
크게 두 가지가 있습니다.
첫 번째는 휴미라 바이오시밀러 제제 중 최초로 고농도 제품을 출시시켰다는 것이고, 두 번째는 citrate라는 성분을 제거시켰다는 것입니다.

논문에서도 위와 같이 언급하고 있습니다.
염증성 장질환(IBD)이라 불리는 크론병(CD)과 궤양성 대장염(UC)의 경우에 초회 용량 160mg, 유지용량 40~80mg으로 다른 대부분의 자가면역성 질환의 초회 요량 40~80mg, 유지용량 40mg의 2배가 필요하다는 것을 알 수 있습니다. 물론 이것도 휴미라 제제가 40mg/0.4ml, 80mg/0.8ml 단위로 나와서 그럴 겁니다.

하지만 기존의 다른 휴미라 바이오시밀러 제제들은 50mg/ml이하의 저농도 제품들이었습니다. 이제 느낌 오시죠?
저농도 제품들은 고농도에 비해 많은 양을 맞아야 합니다. 이 제품은 피하지방층에 찔러서 맞기 때문에 정맥주사처럼 많은 양의 액체를 주입하지 못합니다. 따라서 많은 양을 맞으려면 많은 횟수로 맞아야 합니다. 맞아보신 분들은 아시겠지만 피하지방 주사 아픕니다. 환자들이 싫어하겠죠. 자가면역질환은 코로나처럼 뿅! 낫는 질병이 아닙니다. 평생에 걸쳐 약을 복용해야죠. 평생 찌르는 고통의 횟수가 2배 이상 된다고 하면... 끔찍하지 않습니까? 거기다 맞는 횟수가 2배가 되면 개발한 회사야 만든 양이 같을 수도 있지만, 직접 놓는 의료진 노동력은 2배로 들겠죠. 그래서 적게 맞을 수 있는 고농도 제제가 더 실용성이 뛰어나고 CT-P17은 여기에서 경쟁력 있어 보입니다.
여기다 통증을 유발하는 citrate를 제외하고 출시하니 환자들의 선호도를 높일 것으로 보입니다.

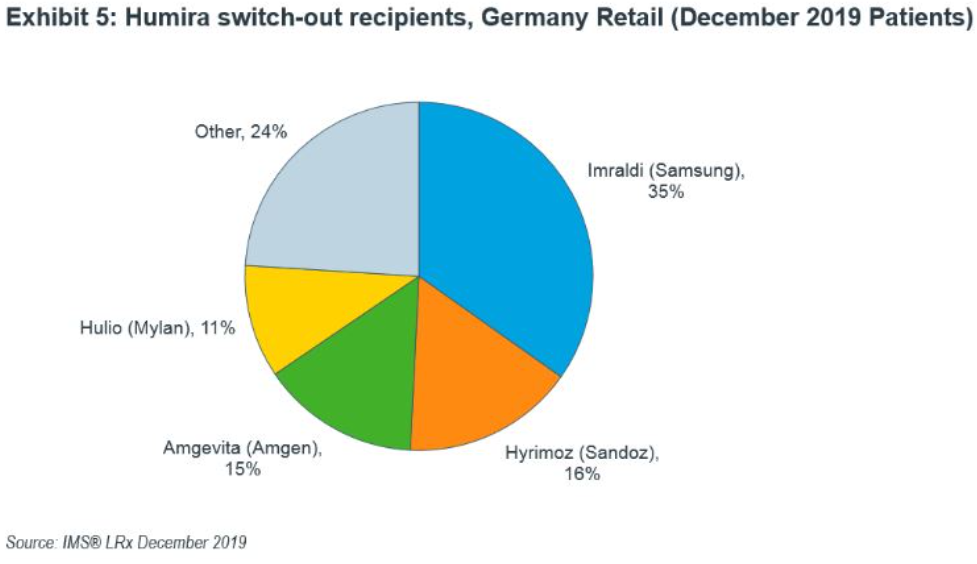
위 사진을 보시면 이미 먼저 진출해 있는 휴미라 바이오시밀러 제품인 삼성바이오에피스의 임랄디가 있습니다. 시장 점유율이 타 경쟁사 비해 나쁘지 않지만 대부분의 시장이 고농도 휴미라 제품에 여전히 묶여있습니다. 심지어 임랄디로 갔다가 다시 휴미라로 돌아간 환자의 비율도 높습니다. 따라서, 앞으로의 바이오시밀러 업체들의 신제품은 고농도 휴미라 제품의 시장점유율을 나눠먹어야 합니다. 이 점에서 CT-P17은 시장을 잘 타게팅하였다고 볼 수 있습니다.
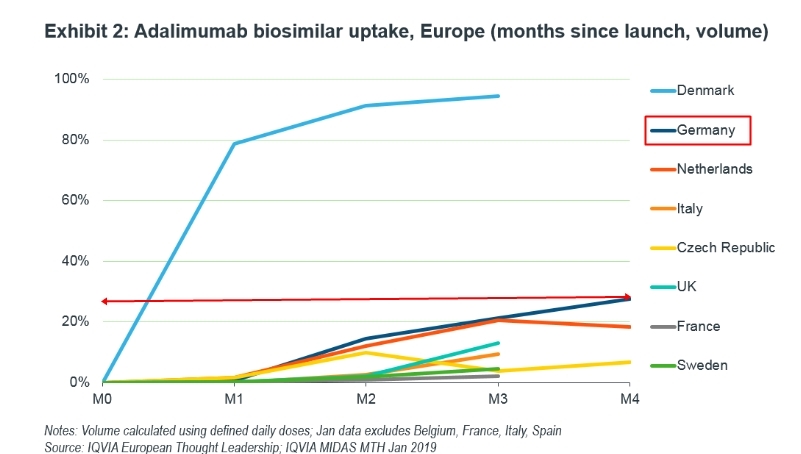
덴마크를 제외한 타 EU 국가들에서 바이오시밀러는 쉽게 점유율을 높이지 못하고 있습니다. CT-P17이 이 점유율을 올릴 수 있을지 지켜볼만합니다.

문제는 미국 시장 진입의 산도 넘어야 합니다. 훌리오라는 휴미라 바이오시밀러 제제 개발 회사는 FDA에서 사용 승인을 받았으나 휴미라의 특허권 승인으로 인해 2023년 1월까지 특허료를 AbbVie에게 내야 합니다. 미국 시장은 기존 제약사들의 보호정책이 심화되어 바이오시밀러 시장의 성장 속도가 낮습니다. 하지만 가격 경쟁력이 뛰어난 바이오시밀러 시장이 성장하는 걸 막을 순 없을 겁니다.
최근 셀트리온 이슈가 자주 나와서 셀트리온 포스팅이 많아졌네요. 다음엔 다른 바이오사들, 또는 다른 섹터들에 대해 다양하게 다뤄보겠습니다.
긴 글 읽어주셔서 감사합니다.
<정리>
1. 셀트리온의 휴미라 바이오시밀러 제제인 유플라이마가 EU 국가들에 사용 승인이 떨어졌다는 기사가 떴다.
2. 논문도 있다. 팩트 맞다.
3. 타 경쟁사 차이점으로 고농도 제품인 것과 시트르산이 제외된 점 두 가지 있다.
4. 휴미라 고농도 바이오시밀러 제품은 유일하므로 시장 점유율 경쟁에서 유리한 고지를 차지할 것이다.
5. 근데 작년부터 있던 이슈라 주가에 선반영 됐을 가능성 높다.
출처)
1) "Adalimumab Monograph for Professionals". Drugs.com. American Society of Health-System Pharmacists. 14 May 2018. Retrieved 18 March 2019.
2) FOREST RAY, "Hulio, Humira Biosimilar, Approved But Not Available Until 2023", Ankylosing Spondylitis News, JULY 13, 2020, FDA Approves Hulio, Humira Biosimilar, to Treat Ankylosing Spondylitis (ankylosingspondylitisnews.com)
3) Kay, J., Jaworski, J., Wojciechowski, R. et al. Efficacy and safety of biosimilar CT-P17 versus reference adalimumab in subjects with rheumatoid arthritis: 24-week results from a randomized study. Arthritis Res Ther 23, 51 (2021). https://doi.org/10.1186/s13075-020-02394-7
5) 관리자, "(셀트지기)희망나눔주주연대 (hopeon.or.kr)
6) 박병우 기자, "[집중분석 ] 바이오시밀러, P와 Q에 대한 치열한 눈치싸움", 팜스탁, 2017-09-26, [집중분석 ] 바이오시밀러, P와 Q에 대한 치열한 눈치싸움 - 팜스탁 (pharmstock.co.kr)
'경제적 자유 > 주식 공부' 카테고리의 다른 글
| IPO 뜻, 공모주 청약 방법, 청약일정 조회하는 법까지 총정리 (0) | 2021.02.24 |
|---|---|
| 삼성전자 주가 분석 : 반도체 용어 뜻 찾기(애널리스트 보고서 보며 용어 찾기 : LSI, IM, CE 등) (2) | 2021.02.17 |
| ETN 투자하는 방법(3) : ETF/ETN 레버리지 상품 수익 구조 이해하기, 주의해야할 점(괴리율, 복리효과, 롤오버) (0) | 2021.02.11 |
| ETN 투자하는 방법(2) : ETF/ETN 상품 수익구조 이해하기(레버리지 상품 이해 전단계) (4) | 2021.02.10 |
| ETN 투자하는 방법(1) : 레버리지 ETF/ETN 교육 받기로 시작 (0) | 2021.02.09 |